La enfermedad de Alzheimer (EA) tiene la distinción históricamente única de ser la única enfermedad crónica común sin prevención o cura conocidas. Esta proposición se vuelve cada vez más nefasta cuando se considera que la marea creciente de Alzheimer tendrá impacto en América del Norte y el resto del mundo en las próximas décadas. En los Estados Unidos, 5.3 millones de personas tienen AD actualmente (representan el 75-80% de todos los casos de demencia), y se espera que ese número aumente a 13.8 millones de personas médica y económicamente insostenibles para 2050.
La idea de que AD es recalcitrante para todas las intervenciones se basa en una creencia que ha sido ampliamente refutada en la última década: que el sistema nervioso es estático y categóricamente inalterable. El gran costo y la coherencia de los ensayos farmacológicos fallidos en las últimas décadas nos llevan a una conclusión central: la enfermedad de Alzheimer es un fenómeno multifactorial que se desarrolla durante varias décadas antes de la aparición de los síntomas y es, en gran parte, el resultado de un estilo de vida.
Afortunadamente, el concepto de neuroplasticidad se está convirtiendo rápidamente en la corriente principal. Un estudio de 2014 de la UCLA, aunque pequeño (mejoría en 9 de cada 10 participantes), mostró por primera vez una reversión de la EA leve a moderada utilizando un enfoque integral de recomendaciones de dieta y estilo de vida individualizadas. De todos los factores sistémicos en juego, quizás ninguno es más crucial de abordar que la resistencia a la insulina.
“DIABETES DEL CEREBRO”
Un hallazgo clave en nuestra comprensión en evolución de la patología relevante es la fuerte correlación entre la AD y la resistencia a la insulina, el síndrome metabólico y la diabetes tipo 2 (DM2). De hecho, hasta el 40% de la patología de la EA se ha atribuido a la hiperinsulinemia. Los niveles más altos de HbA1c se correlacionan con menor capacidad cognitiva y cambios en la microestructura hipocampal, y el estado genético positivo de APOE e4 (el determinante genético más estudiado del riesgo de EA) se correlaciona con un mayor riesgo de DMT2, perfiles lipídicos alterados y enfermedad cardiovascular . Dado que el metabolismo de la glucosa cerebral deteriorado es un aspecto central de la patología de la EA, la investigación sugiere que la intervención en la mediana edad puede ser especialmente crítica para el éxito de los resultados. Además, abordar con éxito la diabetes en etapas posteriores de la vida reduce la conversión del deterioro cognitivo leve a AD y demencia por todas las causas.
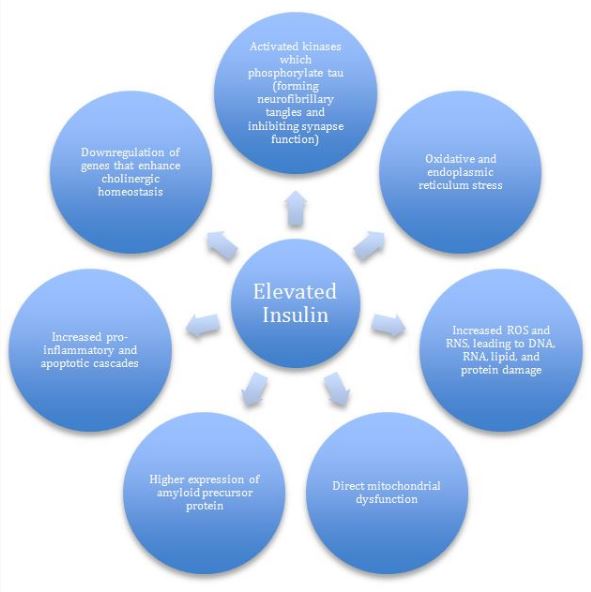
También es bien sabido que las regiones cerebrales (especialmente el hipocampo) que dependen más de la insulina y de la señalización del factor de crecimiento similar a la insulina (IGF) son las más vulnerables a la patología de la EA. Las alteraciones en la señalización de insulina / IGF en el cerebro conducen a un aumento de la expresión de la proteína precursora de β-amiloide (AβPP) y a la acumulación de agregados de AβPP-Aβ. Algunos de los mecanismos propuestos, todos los cuales son al menos parcialmente susceptibles a los enfoques Naturopáticos, se enumeran en la Figura
Figura 1. Efectos de hiperinsulinemia en el cerebro (Adaptado de de la Monte SM, 2012) 11
Un enfoque integral de AD debe ser multifactorial (Tabla 2), pero la base de cualquier terapia exitosa para la demencia debe comenzar con la dieta. Para AD, la base de una dieta exitosa debe tener en cuenta las anormalidades del azúcar en la sangre. El control estricto del azúcar es aún más crucial en la población de personas mayores, ya que las preferencias del gusto aumentan por alimentos dulces ricos en calorías y carbohidratos, pobres en micronutrientes.
CUIDE SU DIETA
Se estudió una dieta híbrida mediterránea y DASH (ver Tabla 1), con varias modificaciones cognitivas específicas, en una población de 923 participantes que fueron seguidos durante 4,5 años. Llamado acertadamente la dieta MIND, los que obtuvieron puntajes en el 1/3 más alto de adherencia (adherencia estricta) a la dieta tuvieron una reducción del 53% en el riesgo de desarrollar AD. Igualmente de impresionante, aquellos que estaban en el tercio medio (adherencia moderada) tenían una reducción de riesgo del 35%.
Sin embargo, para la mayoría de los pacientes que consultan a un Naturópata ND, el cumplimiento de esta dieta no parecerá especialmente estricto; por ejemplo, se obtuvo un puntaje positivo al limitar la carne roja a un 4 veces excesivo por semana. Además, el índice glucémico de los alimentos consumidos no se consideró medible, lo que brinda una oportunidad adicional para optimizar la dieta. Aún así, la dieta MIND se asoció con una tasa más lenta de deterioro cognitivo equivalente a 7,5 años de edad mental. Si bien el resultado del estudio se relaciona más con la prevención que con el tratamiento, los mismos principios se pueden aplicar a las personas con un diagnóstico precoz, ya que los cambios patológicos generalmente ocurren mucho antes de que aparezcan los síntomas.
Tabla 1. Dieta MIND utilizada en el estudio clínico
Alimentos a consumir
· Verduras de hoja verde (p. Ej., Espinacas y hojas de ensalada): al menos 6 porciones / semana
· Otras verduras: al menos 1 porción / día
· Nueces: 5 porciones / semana
· Bayas: 2 o más porciones / semana
· Frijoles: al menos 3 porciones / semana
· Granos enteros: 3 o más porciones / día
· Pescado: una vez por semana
· Aves de corral (por ejemplo, pollo o pavo): 2 veces / semana
· Aceite de oliva: Úselo como su principal aceite de cocina
· Vino: 1 vaso / día
Comidas que se deben evitar
· Carne roja: Menos de 4 porciones / semana
· Mantequilla y margarina: menos de 1 cucharada / día
· Queso: menos de 1 porción / semana
· Pasteles y dulces: menos de 5 porciones / semana
· Comida frita o rápida: menos de 1 porción / semana
AYUNO SALUTOGENICO
El ayuno salutogénico ha sido durante mucho tiempo un enfoque de los Naturópatas, y se utilizó mucho en los orígenes de la cura natural. En los países industrializados donde los alimentos (rápidos) están disponibles, la población está comiendo en exceso a tasas sin precedentes. Una mayor ingesta de calorías y grasas en 980 individuos mayores estudiados durante 4 años se asoció con un riesgo AD 2.3 veces mayor, pero solo en aquellos que tenían APOE4 +. En un estudio de 18 años, los que habitualmente consumían menos calorías tenían tasas de EA más bajas, y por cada 1,0 de aumento en el IMC a los 70 años, el riesgo de EA aumentó en un 36%. En una revisión de los efectos metabólicos de las dietas restringidas en calorías o ayunos intermitentes, la sensibilidad a la insulina medida a través de HOMA-IR se correlacionó bien con la pérdida de peso en la mayoría de los estudios; Un estudio típico correlacionó una pérdida de peso del 8% con una mejora del 33% en la sensibilidad a la insulina. De manera similar, se observaron reducciones en la insulina en ayunas de 20-31% después de 8-12 semanas de tratamiento. En la mayoría de los estudios de ayuno intermitente o en días alternos, la pérdida de grasa visceral es paralela a la pérdida de peso general, del orden de 4-7% durante 6-24 semanas de tratamiento. dieciséis
Aunque actualmente faltan suficientes estudios de resultados a largo plazo en humanos (se han llevado a cabo muchos estudios en animales), existen varios ensayos pequeños. La restricción calórica (CR) de 3-4 meses mejoró la función cognitiva en los ancianos, según lo medido por las puntuaciones de memoria verbal, en paralelo con la insulina en ayunas reducida y la proteína C-reactiva (PCR).
Hay varios mecanismos celulares potenciales involucrados con estas dietas (que se cree que son el resultado del efecto hormonal de la restricción energética), los mejores estudiados incluyen estrés oxidativo reducido, bioenergética celular mejorada, señalización mejorada del factor neurotrófico (BDNF y FGF2) y reducción inflamación (TNFα reducido, IL-1β e IL-6). Si bien existen muchas variaciones de la restricción calórica y el ayuno intermitente, se esperan mayores perfiles de cumplimiento y seguridad con ayunos nocturnos diarios (que van desde un mínimo de 12 horas hasta 16 o 18 horas) en comparación con los ayunos más largos. Por supuesto, cada paciente debe ser evaluado de forma individual y supervisado cuidadosamente durante el tratamiento.
Otro beneficio clave del ayuno intermitente o la restricción calórica es la inducción de la cetosis después de 12-16 horas de ayuno. El hipometabolismo de la glucosa (que conduce a la privación crónica de energía cerebral) en los pacientes con EA es aproximadamente un 20-25% más bajo que en las personas cognitivamente normales de la misma edad. En los propensos a la diabetes, estos cambios a menudo son más pronunciados en la corteza frontal, y en algunos se pueden descubrir a edades tan tempranas como los 24 años. Es importante destacar que la capacidad de producir y utilizar cuerpos cetónicos como un sustrato alternativo en realidad puede aumentar con la edad y con la resistencia a la insulina (que causa un aumento en los transportadores de monocarboxilato). Si bien solo tenemos 33 g / día de glucosa de las reservas de glucógeno, el cerebro humano promedio metaboliza 110-145 g / día de glucosa para la producción de ATP. Por esta razón, se requiere una fuente alternativa de combustible y, afortunadamente, la naturaleza lo proporciona: cuerpos cetónicos (específicamente beta-hidroxibutirato y acetoacetato, que se beta-oxidan en el hígado a partir de ácidos grasos de cadena larga).
Las dietas cetogénicas tienden a ser altas en grasas y restrictivas de los carbohidratos. Un perfil de macronutrientes común incluiría un máximo de 30 g de carbohidratos, 1 g de proteínas / kg de peso corporal y el resto de calorías provenientes de grasas (20% saturadas / 80% poliinsaturadas y monoinsaturadas). Una alternativa que probablemente se encuentre con mayor cumplimiento es el consumo directo de triglicéridos de cadena media (TCM), más fácilmente disponibles en el aceite de coco, que aumentan los niveles de cuerpos cetónicos independientemente de la ingesta de macronutrientes; Los aceites TCM proporcionan una relación dosis-respuesta lineal al aumento de cetonas en plasma. Una dosis terapéutica es de 2 cucharadas de aceite de coco virgen orgánico por día, que proporciona un promedio de 20 g de TCM. Esta dosis debe graduarse gradualmente para evitar trastornos digestivos. Por otro lado, los aceites TCM han demostrado ser seguros, con un tratamiento de 30 días de 30 g / día de TCM que no afectan negativamente el peso corporal, contenido de grasa corporal, índice de masa corporal, glucosa sérica, insulina, triglicéridos, colesterol o grasa libre ácidos.
La verdadera enfermedad familiar de Alzheimer es extremadamente rara, y si bien hay un componente genético (estado positivo de APOE4), este efecto puede mitigarse con un enfoque Naturopático. AD es, por supuesto, una enfermedad que se manifiesta en la patología cerebral de los órganos terminales. Visto de esta manera reduccionista, es probable que continúe siendo una carga que afecta cada vez más al mundo industrializado. Sin embargo, si se aborda como una enfermedad sistémica con susceptibilidad específica del cerebro , tal vez la profesión Naturopática pueda estar a la vanguardia de preservar todo lo que está en juego.
Tabla 2. Un enfoque multifactorial para la enfermedad de Alzheimer
Intervención. Vitamina D. Resultados del estudio: Comparado con aquellos con niveles de 25OHD> 50 nmol / L …La deficiencia grave (<25 nmol / L) se asoció con un aumento del 122% en el riesgo de demencia por cualquier causa; y la deficiencia (25-50 nmol / L) se asoció con un aumento del 51% del riesgo.
Intervención. Ácido Docosahexaenoico (DHA). Resultados del estudio: Epidemiológico e intervención estudios muestran mejoras en la memoria.
Intervención. Vitaminas B / baja de homocisteína. Resultados del estudio: El tratamiento con complejo B en sujetos con homocisteína> 11.3 μmol / L condujo a mejoras en la cognición global (MMSE), memoria episódica y memoria semántica. La atrofia cerebral (y homocisteína> 13 μmol / L) fue 53% menor en el grupo de tratamiento con vitamina B activa.
Intervención. Meditación. Resultados del estudio: La reducción del estrés basada en Mindfulness durante 8 semanas condujo a una mayor conectividad funcional y a una atrofia hipocampal reducida.
Intervención. Compromiso social. Resultados del estudio: Permanecer o volverse social / físicamente activo durante un período de 10 años se asoció con una disminución de hasta 49% en el riesgo de demencia durante los 10 años siguientes. La calidad de las relaciones parece más importante que la cantidad.
Intervención. Compromiso cognitivo. Resultados del estudio: La historia de la actividad cognitiva permanente puede respaldar un mejor rendimiento cognitivo; esta relación está mediada por un mecanismo independiente de la carga de Aβ.
Intervención. Ejercicio aeróbico. Resultados del estudio: Un metaanálisis de 2016 mostró mejoras en la demencia específicamente con ejercicios aeróbicos pero no con otros ejercicios.
Intervención. Toxicidad ambiental. Resultados del estudio: Los metales neurotóxicos como el plomo, el mercurio, el aluminio, el cadmio y el arsénico, así como algunos pesticidas y nanopartículas basadas en metales, han estado involucrados en la EA debido a su capacidad de aumentar el péptido Aβ y la fosforilación de P-Tau.
Intervención. Acupuntura. Resultados del estudio: Un metanálisis encontró una diferencia estadísticamente significativa entre la acupuntura más el donepezilo versus el donepezilo solo para mejorar la puntuación del MMSE.
Intervención. Dormir. Resultados del estudio: La melatonina (0,5 mg) en EA de leve a moderada se vinculó a la mejora en los parámetros del sueño y puntuaciones del MMSE (1,5 puntos) después de 24 semanas, mientras que el grupo placebo puntuaciones del MMSE se deterioraron en 2,8 puntos.
(25OHD = 25-hidroxivitamina D; Aβ = beta-amiloide; P-Tau = proteína tau; MMSE = Examen de estado mini-mental).
- Alzheimer’s Association. Alzheimer’s disease facts and figures. Alzheimers Dement. 2015;11(3):332-384.
- Bredesen DE. Reversal of cognitive decline: a novel therapeutic program. Aging (Albany NY). 2014;6(9):707-717.
- Biessels GJ, Staekenborg S, Brunner E, et al. Risk of dementia in diabetes mellitus: a systematic review. Lancet Neurol. 2006;5(1):64-74.
- Kopf D, Frolich L. Risk of incident Alzheimer’s disease in diabetic patients: a systematic review of prospective trials. J Alzheimers Dis. 2009;16(4):677-685.
- Kerti L, Witte AV, Winkler A, et al. Higher glucose levels associated with lower memory and reduced hippocampal microstructure. 2013;81(20):1746-1752.
- El-Lebedy D, Raslan HM, Mohammed AM. Apolipoprotein E gene polymorphism and risk of type 2 diabetes and cardiovascular disease. Cardiovasc Diabetol. 2016;15:12.
- Willette AA, Bendlin BB, Starks EJ, et al. Association of Insulin Resistance With Cerebral Glucose Uptake in Late Middle-Aged Adults at Risk for Alzheimer Disease. JAMA Neurol. 2015;72(9):1013-1020.
- Cooper CC, Sommerlad A, Lyketsos CG, Livingston G. Modifiable predictors of dementia in mild cognitive impairment: a systematic review and meta-analysis. Am J Psychiatry. 2015;172(4):323-334.
- de la Monte SM, Wands JR. Review of insulin and insulin-like growth factor expression, signaling, and malfunction in the central nervous system: relevance to Alzheimer’s disease. J Alzheimers Dis. 2005;7(1):45-61.
- Freude S, Schilbach K, Schubert M. The role of IGF-1 receptor and insulin receptor signaling for the pathogenesis of Alzheimer’s disease: from model organisms to human disease. Curr Alzheimer Res. 2009;6(3):213-223.
- de la Monte SM. Contributions of Brain Insulin Resistance and Deficiency in Amyloid-Related Neurodegeneration in Alzheimer’s Disease. Drugs. 2012;72(1):49-66.
- Mundas D, Cooper JK, Weiler PG, et al. Dietary preference for sweet foods for patients with dementia. J Am Geriatr Soc. 1990;38(9):999-1007.
- Morris MM, Tangney CC, Wang Y, et al. MIND diet associated with reduced incidence of Alzheimer’s disease. Alzheimers Dement. 2015;11(9):1007-1014.
- Luchsinger JA, Tang MX, Shea S, Mayeux R. Caloric intake and the risk of Alzheimer disease. Arch Neurol. 2002;59(8):1258-1263.
- Gustafson D, Rothenberg E, Blennow K, et al. An 18-year follow-up of overweight and risk of Alzheimer disease. Arch Intern Med. 2003;163(13):1524-1528.
- Barnosky AR, Hoddy KK, Unterman TG, Varady KA. Intermittent fasting vs daily calorie restriction for type 2 diabetes prevention: a review of human findings. Transl Res. 2014;164(4):302-311.
- Witte AV, Fobker M, Gellner R, et al. Caloric restriction improves memory in elderly Proc Natl Acad Sci U S A. 2009;106(4):1255-1260.
- Mattson MP. Energy intake and exercise as determinants of brain health and vulnerability to injury and disease. Cell Metab. 2012;16(6):706-722.
- Arumugam TV, Phillips TM, Cheng A, et al. Age and energy intake interact to modify cell stress pathways and stroke outcome. Ann Neurol. 2010;67(1):41-52.
- Cunnane S, Nugent S, Roy M, et al. Brain fuel metabolism, aging, and Alzheimer’s disease. 2011;27(1):3-20.
- Castellano CA, Baillargeon JP, Nugent S, et al. Regional brain glucose hypometabolism in young women with polycystic ovary syndrome: possible link to mild insulin resistance. PLoS One. 2015;10(12):e0144116.
- London ED, Margolin RA, Duara R, et al. Effects of fasting on ketone body concentrations in healthy men of different ages. J Gerontol. 1986;41(5):599-604.
- Robinson AM, Williamson DH. Physiological roles of ketone bodies as substrates and signals in mammalian tissues. Physiol Rev. 1980;60(1):143-187.
- Cunnane SC, Courchesne-Loyer A, St-Pierre V, et al. Can ketones compensate for deteriorating brain glucose uptake during aging? Implications for the risk and treatment of Alzheimer’s disease. Ann N Y Acad Sci. 2016;1367(1):12-20.
- Courchesne-Loyer A, Fortier M, Tremblay-Mercier J, et al. Stimulation of mild, sustained ketonemia by medium-chain triacylglycerols in healthy humans: estimated potential contribution to brain energy metabolism. Nutrition. 2013;29(4):635-640.
- Dysken MW, Sano M, Asthana S, et al. Effect of vitamin E and memantine on functional decline in Alzheimer disease: the TEAM-AD VA cooperative randomized trial. JAMA. 2014;311(1):33-44.
- Littlejohns TJ, Henley WE, Lang IA, et al. Vitamin D and the risk of dementia and Alzheimer disease. Neurology. 2014;83(10):920-928.
- Yurko-Mauro K, Alexander DD, Van Elswyk ME. Docosahexaenoic acid and adult memory: a systematic review and meta-analysis. PLoS One. 2015;10(3):e0120391.
- Yurko-Mauro K, McCarthy D, Rom D, et al. Beneficial effects of docosahexaenoic acid on cognition in age-related cognitive decline. Alzheimers Dement. 2010;6(6):456-464.
- de Jager CA, Oulhaj A, Jacoby R, et al. Cognitive and clinical outcomes of homocysteine-lowering B-vitamin treatment in mild cognitive impairment: a randomized controlled trial. Int J Geriatr Psychiatry. 2012;27(6):592-600.
- Smith AD, Smith SM, de Jager CA, et al. Homocysteine-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment: a randomized controlled trial. PLoS One. 2010;5(9):e12244.
- Wells RE, Yeh GY, Kerr CE, et al. Meditation’s impact on default mode network & hippocampus in mild cognitive impairment: a pilot study. Neurosci Lett. 2013;556:15-19.
- Foubert-Samier A, Le Goff M, Helmer C, et al. Change in leisure and social activities and risk of dementia in elderly cohort. J Nutr Health Aging. 2014;18(10):876-882.
- Amieva H, Stoykova R, Matharan F, et al. What aspects of social network are protective for dementia? Not the quantity but the quality of social interactions is protective up to 15 years later. Psychosom Med. 2010;72(9):905-911.
- Gidicsin CM, Maye JE, Locascio JJ, et al. Cognitive activity relates to cognitive performance but not to Alzheimer disease biomarkers. Neurology. 2015;85(1):48-55.
- Groot C, Hooghiemstra AM, Raijmakers PJ, et al. The effect of physical activity on cognitive function in patients with dementia: A meta-analysis of randomized control trials. Ageing Res Rev. 2016;25:13-23.
- Chin-Chan M, Navarro-Yepes J, Quintanilla-Vega B. Environmental pollutants as risk factors for neurodegenerative disorders: Alzheimer and Parkinson diseases. Front Cell Neurosci. 2015;9:124.
- Zhou J, Peng W, Xu M, et al. The effectiveness and safety of acupuncture for patients with Alzheimer disease: a systematic review and meta-analysis of randomized controlled trials. Medicine (Baltimore). 2015;94(22):e933.
- Wade AG, Farmer M, Harari G, et al. Add‐on prolonged‐release melatonin for cognitive function and sleep in mild to moderate Alzheimer’s disease: a 6‐month, randomized, placebo controlled, multicenter trial. Clin Interv Aging. 2014;9:947-