El síndrome metabólico es una afección común que puede aumentar las complicaciones en el tratamiento del cáncer de mama y aumentar el riesgo de recurrencia. Si bien la metformina es un agente terapéutico prometedor, las intervenciones intensivas en el estilo de vida y las terapias naturales pueden implementarse de manera segura y efectiva en personas con síndrome metabólico antes de que se vuelvan diabéticas. Las intervenciones Naturopáticas como el ejercicio, el asesoramiento dietético, la fitoterapia y los suplementos dietéticos pueden ayudar a optimizar los resultados durante y después del tratamiento del cáncer. Las estrategias discutidas en este artículo incluyen varias dietas, manejo de niveles de cortisol, sueño, evitación de compuestos obesogénicos y uso de los nutrientes cromo, zinc, vanadio, magnesio, mioinositol, ácido alfa lipoico, aceite de pescado, vitamina D, CoQ10, L-carnitina, amargos a base de hierbas, canela, berberina y té verde.
El síndrome metabólico afecta aproximadamente a un tercio de la población general en los Estados Unidos. El síndrome metabólico y su precursor, la resistencia a la insulina, son factores de riesgo modificables para el cáncer de mama. El síndrome metabólico se asocia con un aumento del 52% en el riesgo de cáncer de mama posmenopáusico. Los pacientes con cáncer de mama con síndrome metabólico tienen 3 veces la tasa de recurrencia de pacientes sin síndrome metabólico, y los pacientes con cáncer metastásico de seno con síndrome metabólico tienen peores resultados. Los pacientes con cáncer con síndrome metabólico también tienen más complicaciones postoperatorias y estancias hospitalarias más prolongadas. La insulina alta causa elevaciones en el factor 1 de crecimiento insulinoide (IGF-1), el factor de crecimiento endotelial vascular (VEGF) y la actividad aromatasa, todos los cuales promueven el cáncer de mama. Por lo tanto, cuando se trata el terreno interno para prevenir la aparición, recurrencia o progresión del cáncer de mama, es importante detectar y tratar de forma efectiva la resistencia a la insulina y el síndrome metabólico.
La metformina actualmente se está investigando como un agente terapéutico en el cáncer de mama. Muchos estudios observacionales han informado sobre la reducción de la incidencia de cáncer y / o la mortalidad entre los diabéticos que reciben metformina (frente a otras drogas) para tratar la diabetes tipo 2. El uso de metformina en el momento del diagnóstico de cáncer de mama se ha asociado con mejores características clínico-patológicas. Además, el aumento de las tasas de respuesta patológica completa a la quimioterapia se han observado en pacientes con cáncer de mama diabéticos que reciben metformina (24%) en comparación con los diabéticos que no recibieron metformina (8%). A pesar de estos estudios alentadores, la mayoría de las personas no puede recibir metformina porque es el tratamiento estándar solo para los diabéticos tipo II, no para los pacientes con síndrome metabólico. Las intervenciones Naturopáticas pueden desempeñar un papel importante en el apoyo a estos pacientes para optimizar sus tratamientos convencionales y reducir el riesgo de recurrencia.
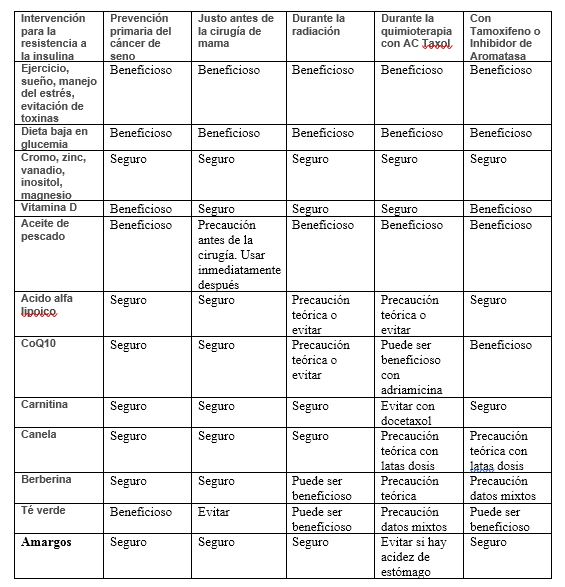
Los tratamientos del cáncer de seno en sí pueden exacerbar la resistencia a la insulina subyacente. La dexametasona, que se usa comúnmente durante la quimioterapia contra el cáncer de mama, causa hiperglucemia. En las mujeres con sobrepeso premenopáusicas, el uso de tamoxifeno disminuyó la sensibilidad a la insulina en casi 7 veces en comparación con las mujeres que no tomaron tamoxifeno. En los sobrevivientes de cáncer de mama más viejos, el tamoxifeno se asocia con una mayor incidencia de diabetes. Además, los estabilizadores del ánimo tales como los inhibidores selectivos de la recaptación de serotonina (ISRS), antidepresivos tricíclicos y antipsicóticos atípicos pueden afectar a la ingesta de alimentos y la acumulación de lípidos, lo que conduce a la obesidad. Por otro lado, muchas de las intervenciones Naturopáticas utilizadas rutinariamente como complemento del cáncer de mama se dirigen al síndrome metabólico y abordan algunos de los efectos adversos de los medicamentos. Por esta razón, es útil para los Naturópatas abordar la resistencia a la insulina y el síndrome metabólico antes, durante y después de un diagnóstico de cáncer de mama. Al final de este artículo, se proporciona un cuadro de interacciones para abordar la combinación de intervenciones con cirugía, radiación, quimioterapia y medicamentos bloqueadores de hormonas.
Examen clínico
Es importante diferenciar entre diabetes tipo II, síndrome metabólico y resistencia a la insulina. Los médicos de vez en cuando se encontrarán con pacientes con cáncer de mama que son diabéticos tipo 2 no diagnosticados y pueden alentar o prescribir metformina en esta población. Con más frecuencia, los médicos encuentran el síndrome metabólico no diagnosticado o la resistencia a la insulina que se puede revertir a través de intervenciones de estilo de vida y terapias naturales.
Según el Grupo de Trabajo de Servicios Preventivos de los EE. UU. Y la Asociación Estadounidense de Diabetes, la diabetes mellitus se diagnostica con:
• Un nivel de glucosa en plasma en ayunas ≥126 mg / d (7.0 mmol / L)
Un diagnóstico de síndrome metabólico, según el Programa nacional de educación sobre el colesterol de los EE. UU. Adult Treatment Panel III (2001), requiere al menos 3 de los siguientes:
• Obesidad central : circunferencia de la cintura ≥88 cm o 35 pulgadas (mujeres), ≥102 cm o 40 pulgadas (hombres)
• Dislipidemia : triglicéridos (TG) ≥ 150 mg / dL (1.7 mmol / L)
• Dislipidemia : colesterol de lipoproteínas de alta densidad (HDL-C) <50 mg / dL (mujeres) <40 mg / dL (hombres)
• Presión arterial ≥ 130/85 mmHg (o tratado para la hipertensión)
• Glucosa plasmática en ayunas ≥ 110 mg / dL (6.1 mmol / L)
Los factores de riesgo para el síndrome metabólico incluyen la edad superior a 40 a 45 años, obesidad, grasa abdominal, estilo de vida sedentario, antecedentes de diabetes gestacional y niveles elevados de cortisol.
La resistencia a la insulina (IR) es una condición fisiológica más que un diagnóstico per se. Se produce cuando las células del cuerpo tienen una capacidad reducida para responder a la acción de la insulina, por lo que para compensar, el páncreas secreta más insulina. Los niveles altos de insulina se asocian con niveles más altos de glucosa, aumento de la presión sanguínea, triglicéridos elevados y lipoproteína de baja densidad (LDL) y concentraciones reducidas de HDL. 14 La Evaluación del Modelo Homeostático para la Resistencia a la Insulina (HOMA-IR) es un puntaje que a menudo se usa para definir IR en la investigación.
Existe una investigación contradictoria con respecto a qué pruebas se usan mejor para detectar el síndrome metabólico en pacientes con cáncer de mama y cuáles son las pruebas más predictivas de la aparición del cáncer de mama y el riesgo de recurrencia en esta población. Además, las mujeres a veces pueden ser delgadas en apariencia pero metabólicamente obesas, y este subtipo con resistencia a la insulina puede pasarse por alto fácilmente. A continuación se presentan las principales pruebas para considerar ordenar en pacientes con cáncer de mama de alto riesgo y sobrevivientes de cáncer de mama:
• Índice de masa corporal (IMC) en kg / m2 = [masa (lb) / (altura (en)) 2 ] x 703. IMC <25 kg / m2 = normal, ≥25 kg / m2 = sobrepeso / obesidad. Algunas investigaciones concluyeron que el IMC <25 kg / m2 reduce el riesgo de recurrencia. Otra investigación mostró que las mujeres con bajo peso (IMC <18.5 kg / m2) o obesidad mórbida (IMC> 30 kg / m2) tenían un mayor riesgo de recurrencia, mientras que las mujeres normales o con sobrepeso con IMC de 18.5-30 kg / m2 tenían el menor riesgo de recurrencia.
• Insulina en ayunas : las mujeres tienen un mayor riesgo de cáncer de mama en los años previos a un diagnóstico de diabetes cuando los niveles de insulina son altos. La insulina normal en ayunas es <25 μIU / mL. En la Iniciativa de Salud de la Mujer, la insulina en ayunas> 8.8 μUI / ml aumentó el riesgo. 17 Sin embargo, en un metanálisis de 2013, la insulina sérica no se asoció con el riesgo de cáncer de mama cuando se controló el IMC.
• Perfil de lípidos : los pacientes con síndrome metabólico y triglicéridos elevados tienen un mayor riesgo de recurrencia del cáncer de mama. 19 Losrangos ideales pueden ser TG <100 mg / dL y HDL> 50 mg / dL.
• Hemoglobina A1C (HgA1C) : Normal es <6.0%. En teoría, el rango ideal puede ser <5.5%
• Proteína C-reactiva de alta sensibilidad (hsCRP) : la resistencia a la insulina aumenta la inflamación y la PCR. 20 Normal es <3.0 mg / L. El rango ideal es <1.0 mg / L para el riesgo cardiovascular.
• Vitamina D : la deficiencia de vitamina D se asocia con la resistencia a la insulina y un mayor riesgo de recurrencia y muerte en pacientes con cáncer de mama en etapa inicial. El objetivo es 40-60 ng / ml (ver a continuación).
• Glucosa en ayunas : <100 mg / dL (5.56 mmol / L) es ideal.
Péptido C: la prueba del péptido C refleja la insulina producida solo por el páncreas. Es una alternativa útil o complementaria a las pruebas de insulina en ayunas porque se ve menos afectada por el ayuno y puede evaluar la producción de insulina en pacientes que reciben tratamiento con insulina. Según un estudio, en mujeres mayores, el péptido C> 3.09 ng / ml aumentaba el riesgo de cáncer de mama. Sin embargo, en un metanálisis de 2013, cuando se controló el IMC, el péptido C no se asoció con el riesgo de cáncer de mama. Tenga en cuenta que esto solo se aplica a la prevención primaria. Las mujeres con un diagnóstico de cáncer de mama existente interesadas en la prevención secundaria o la reducción de la progresión de la enfermedad pueden aspirar a niveles ideales, como <2 ng / ml o en mujeres mayores de 55 años, <3.09 ng / mL.
Evaluación del modelo de homeostasis: resistencia estimada a la insulina (HOMA-IR) : este puntaje se usa para definir la resistencia a la insulina en la investigación. HOMA-IR = (glucosa en ayunas en mmol / L x insulina en ayunas) /22.5 OR (glucosa en ayunas en mg / dL x insulina en ayunas) / 405. HOMA-IR ≥ 2.50 indica resistencia a la insulina. HOMA-IR mostró una tendencia positiva para la recurrencia en los receptores de estrógeno / receptor de progesterona (ER / PR) -vivientes negativos de cáncer de mama, pero no ER / PR positivos. Una calculadora HOMA-IR está disponible en www.hcvsociety.org/files /HOMACalc.htm .
Ácido úrico : varios estudios han concluido que los niveles altos de ácido úrico pueden contribuir de forma independiente a la resistencia a la insulina. En teoría, el rango ideal es <5.5 mg / dL.
Factor de crecimiento similar a la insulina 1 (IGF-1) : un metanálisis con estudios publicados hasta 2006 llegó a la conclusión de que la asociación de IGF-1 con el riesgo de cáncer de mama se limita a las mujeres premenopáusicas. Sin embargo, un análisis conjunto de 17 estudios prospectivos hasta 2010 mostró que el IGF-1 circulante se asocia positivamente con el riesgo de cáncer de mama en mujeres premenopáusicas y posmenopáusicas con tumores ER-positivos.
Homocisteína : los niveles de homocisteína pueden aumentar con la edad, cuando un paciente fuma y con algunos medicamentos. La homocisteína puede ser elevada en mujeres con variaciones en la secuencia del ADN en el metabolismo del ácido fólico. Este polimorfismo de un solo nucleótido de metilentetrahidrofolato reductasa (MTHFR SNP) también puede afectar el metabolismo de los estrógenos. Si los pacientes con cáncer de mama tienen antecedentes de trastornos del estado de ánimo y niveles elevados de homocisteína, se recomienda realizar pruebas de MTHFR.
Adiponectina : Cuanto más obeso es el paciente, más bajos son los niveles de adiponectina en la sangre. Los niveles bajos de adiponectina se han asociado con una mayor incidencia de enfermedad cardiovascular relacionada con la obesidad, resistencia a la insulina y diabetes tipo II. En las mujeres posmenopáusicas, la adiponectina sérica alta se asoció con una disminución del riesgo de cáncer de mama. En los sobrevivientes de cáncer de mama, la baja de adiponectina se asoció con un mayor riesgo de recurrencia en pacientes ER / PR negativos pero no en ER / PR positivos.
El cáncer puede comportarse como una planta anual o una planta perenne. La cirugía, la radiación y la quimioterapia son tratamientos necesarios para eliminar esta planta. Sin embargo, también debemos tratar el terreno de la oncología para que el entorno interno sea desfavorable para el regreso del cáncer. Cuando el síndrome metabólico es parte del terreno de la oncología, se requiere un enfoque multifacético que incluya ejercicio, repleción de nutrientes, dieta y manejo del estrés.
El ejercicio disminuye la resistencia a la insulina, mejora el estado de ánimo, disminuye la fatiga, mejora el sueño, controla el peso, reduce los bochornos, mejora la inmunidad y previene la osteoporosis. Se ha demostrado que el ejercicio mejora la supervivencia en pacientes con cáncer de mama, próstata y colorrectal. En un estudio de 3.000 sobrevivientes de cáncer de mama, las mujeres que ejercitaban de 3 a 5 horas por semana tenían casi un 50% de reducción en la recurrencia. El diez por ciento de los cánceres de seno incidentes se atribuyen a la inactividad. El ejercicio debe usarse para la prevención primaria del cáncer de mama.
La dieta y el ejercicio pueden ser incluso más poderosos que la metformina para prevenir la diabetes. En un gran estudio titulado “El Programa de Prevención de la Diabetes”, los participantes de alto riesgo recibieron placebo, metformina o intervención intensiva en el estilo de vida y se les dio seguimiento durante un promedio de 3 años. La incidencia de diabetes se redujo en un 58% con la intervención intensiva en el estilo de vida y en un 31% con la metformina en comparación con el placebo. Los 3 grupos se les ofreció la intervención del estilo de vida implementado grupo y monitoreados hasta 10 años de seguimiento. La incidencia de diabetes a los 10 años se redujo en 34% en el grupo de estilo de vida y 18% en el grupo de metformina, demostrando que la intervención intensiva en el estilo de vida sigue siendo el tratamiento más efectivo para la prevención de la diabetes y que las mejoras pueden persistir durante 10 años.
Consideraciones dietéticas
Una serie de dietas diferentes puede ser útil en el tratamiento del síndrome metabólico, incluida la dieta mediterránea, la dieta DASH, una dieta vegetariana, restricción calórica y una dieta cetogénica. Los elementos comunes en todas estas dietas son baja en azúcar y alta ingesta de vegetales. A continuación se encuentra un resumen de la investigación sobre diversas intervenciones dietéticas.
• Eliminación de azúcares simples : soda, jarabe de maíz con alto contenido de fructosa, azúcar blanco y harina blanca. Se ha demostrado que una dieta baja en calorías y baja en glucemia beneficia a los pacientes con resistencia a la insulina y diabetes tipo 2. 39,40 Los alimentos de índice glicémico bajo (GI), en virtud de su lenta digestión y absorción, producen aumentos graduales en los niveles de azúcar y de insulina en la sangre y reducen los niveles de insulina y la resistencia a la insulina. Las dietas con bajo IG han demostrado mejorar los niveles de glucosa y lípidos en personas con diabetes (tipo 1 y tipo 2). Un buen recurso en línea es www.glycemicindex.com . Los alimentos con un GI> 40 son bajos, con un GI moderado de 40 a 60 y un IG alto es> 61 (carbohidratos refinados y simples).
• Dieta alta en fibra : la fibra soluble en agua reduce el índice glucémico de carbohidratos, aumenta la sensibilidad del tejido a la insulina, disminuye el azúcar en sangre en ayunas, aumenta la saciedad y mejora los perfiles de lípidos. Las opciones incluyen polvo de cáscara de psyllium, lino, salvado de avena, pectina de manzana, goma guar y chía.
• Incluir stevia : Esteviósido, un componente de la planta Stevia rebaudiana bertoni, es de 25 a 300 veces más dulce que la sacarosa. Tiene acciones antihiperglucemiantes, antihipertensivas, desinflamatorias, antitumorales, antidiarreicas, diuréticas e inmunomoduladoras.
• Dieta mediterránea : en el estudio DIRECT, un ensayo controlado aleatorizado de intervención dietética de 2 años (ECA), 322 participantes fueron aleatorizados en grupos de dieta mediterránea, baja en grasa o baja en carbohidratos. Las dietas bajas en carbohidratos y mediterráneas tuvieron los mejores resultados para la pérdida de peso, el control glucémico y los perfiles lipídicos. 46 En otro ECA de 90 sujetos con obesidad abdominal sin diabetes, después de 2 meses con la dieta mediterránea, las medidas de HOMA-IR, dilatación mediada por flujo y presión arterial diastólica disminuyeron en el grupo de intervención, mientras que el grupo de control permaneció sin cambios.
• Dieta DASH : el plan de dieta DASH fue desarrollado por los Institutos Nacionales de Salud de EE. UU. Para reducir la presión arterial sin medicación. La dieta DASH es rica en frutas, verduras y productos lácteos bajos en grasa o sin grasa. Incluye granos (especialmente granos enteros), carnes magras, pescado, aves, nueces y frijoles. Tiene un alto contenido de fibra y baja a moderada en grasa y sigue las directrices de EE. UU. Para el contenido de sodio. En el estudio de resistencia a la insulina de aterosclerosis, 862 participantes siguieron la dieta DASH durante un año. Hubo efectos beneficiosos sobre la sensibilidad a la insulina, el LDL y el peso. La dieta DASH también puede reducir el riesgo de cáncer de colon.
• Dieta vegetariana : en un ECA de 176 adultos con sobrepeso, los participantes completaron una prueba de 18 meses de vegetarianismo que resultó en pérdida de peso, disminución de triglicéridos y disminución de la relación LDL: HDL. Los altos niveles de proteína animal se han asociado con mayores niveles de cortisol y una mayor resistencia a la insulina.
• Restricción calórica : en un ECA de 107 mujeres premenopáusicas con sobrepeso u obesas, los participantes se sometieron a una dieta con restricción energética del 25% durante 6 meses, ya sea como restricción intermitente (647 calorías / día durante 2 días / semana) o restricción continua (1,499 calorías / día por 7 días / semana). Ambos grupos redujeron el peso, la leptina, la hsCRP, el colesterol total y LDL, los triglicéridos y la presión arterial. Ambos grupos también aumentaron la globulina fijadora de hormonas sexuales y las proteínas 1 y 2 de unión a IGF. La insulina en ayunas y la resistencia a la insulina se redujeron en ambos grupos, pero el efecto fue mayor con la restricción intermitente (P = 0.04).
• Dieta cetogénica : en un ECA de 58 niños y adolescentes obesos, los participantes se sometieron a una dieta cetogénica vs hipocalórica durante 6 meses. Ambos grupos redujeron significativamente su peso, masa grasa, circunferencia de cintura, insulina en ayunas y HOMA-IR (P = 0.009 para cetogénica y P = 0.014 para hipocalórica), pero las diferencias fueron mayores en el grupo cetogénico. Ambos grupos aumentaron significativamente el índice de sensibilidad a la insulina de todo el cuerpo, pero solo el grupo cetogénico incrementó significativamente la adiponectina.
Varios nutrientes han sido investigados en el tratamiento y la prevención del síndrome metabólico.
• Cromo : los estudios fueron mixtos con respecto al impacto del cromo en el síndrome metabólico. El cromo puede aumentar la sensibilidad a la insulina 54 y puede disminuir la glucosa en ayunas y HgA1C.
• Zinc : el zinc está involucrado en la síntesis, el almacenamiento y la liberación de insulina. Los estudios han demostrado que la deficiencia de zinc puede predisponer a la intolerancia a la glucosa, la resistencia a la insulina y la diabetes. Varios estudios demostraron el beneficio del suplemento de zinc para poblaciones adultas y pediátricas para aumentar la sensibilidad a la insulina. Cincuenta y seis mujeres obesas a las que se les administró 30 mg / día de zinc diariamente durante 4 semanas tuvieron niveles disminuidos de insulina, HOMA-IR y leptina.
• Vanadio : existen varios ensayos pequeños no aleatorizados sobre el vanadio. El sulfato de vanadilo 100 mg al día durante 3 semanas mejoró la sensibilidad a la insulina, redujo la glucosa en ayunas y HgA1C en diabéticos tipo 2.
• Magnesio : el magnesio dietético alto previene la progresión de la resistencia a la insulina a la diabetes. 60,61 En un ECA de sobrepeso, pacientes resistentes a la insulina con magnesio sérico normal, pacientes recibieron placebo o 365 mg / día de hidrocloruro de aspartato de Mg durante 6 meses. La suplementación con magnesio resultó en una mejora significativa de la glucosa plasmática en ayunas y algunos índices de sensibilidad a la insulina en comparación con el placebo.
• Inositol : en un ECA de 80 mujeres posmenopáusicas afectadas por el síndrome metabólico, los participantes recibieron placebo o 2 g de mioinositol dos veces al día durante 12 meses. Con la excepción del IMC y la circunferencia de la cintura, todos los parámetros estudiados (glucosa sérica, insulina, HOMA-IR, triglicéridos y total y HDL-C) mejoraron significativamente. En un ensayo reciente de 155 mujeres posmenopáusicas afectadas por el síndrome metabólico con riesgo de cáncer de mama, el uso de 2 g de inositol con 100 mg de ácido alfa lipoico durante 6 meses redujo la puntuación HOMA-IR y mejoró los perfiles lipídicos.
• Ácido alfa lipoico (ALA) : ensayos preliminares y doble ciego han encontrado que la suplementación de 600 a 1.800 mg de ALA por día mejora la sensibilidad a la insulina. sesenta y cinco
• Vitamina D : una revisión sistemática y metaanálisis de estudios prospectivos sobre vitamina D y diabetes tipo 2 y otros resultados metabólicos en más de 210,000 participantes concluyeron que el riesgo relativo para los individuos en tercios superiores versus inferiores de la vitamina D basal era 0,81 (95% IC: 0,71-0,92) para la diabetes; 0,86 (IC 95%: 0,80-0,92) para el síndrome metabólico; y 0,84 (IC del 95%: 0,64 a 1,12) para la resistencia a la insulina. 66 En una revisión de 11 estudios de casos controlados, un nivel sérico de vitamina D de 47 ng / ml se asoció con un riesgo 50% menor de cáncer de mama.
• CoQ10 : en un ECA doble ciego de 74 diabéticos tipo 2, la administración de suplementos con 100 mg de CoQ10 dos veces al día redujo el HgA1C y la presión arterial.
• Aceite de pescado : un metaanálisis de 65 informes publicados mostró que la reducción de triglicéridos promediaba un 25% con el consumo de aceite de pescado de 4 g / día de ácido eicosapentaenoico (EPA) y ácido docosahexaenoico (DHA). 69 Además, el tratamiento de pacientes obesos con 5 g de aceite de pescado al día durante 3 meses aumentó la adinopectina.
• Carnitina : en un ECA de 258 diabéticos tipo 2 no controlados, los participantes tomaron orlistat más 2 g de L-carnitina al día u orlistat solo. Después de 12 meses, hubo un mejor peso corporal, perfil glucémico, HOMA-IR, LDL y adiponectina y una mejoría más rápida en la insulina plasmática en ayunas, colesterol total, TG, leptina, factor de necrosis tumoral alfa (TNF-α) y Hs- CRP en el grupo de carnitina.
• Contraindicación / precaución : la glucosamina puede agravar la resistencia a la insulina.
Con la excepción de la canela, casi todas las hierbas tradicionalmente utilizadas para el control del azúcar en la sangre son amargos. Las hierbas amargas se pueden usar para mejorar la absorción de minerales y al mismo tiempo mejorar la sensibilidad a la insulina y restaurar la función digestiva. Los bitters aumentan la peristalsis en todas partes del tracto digestivo, excepto en el duodeno, donde los bitters reducen la peristalsis para permitir una mejor absorción. Los agrios estimulan el apetito, mientras que al mismo tiempo aumentan la saciedad. Los ejemplos comunes de amargos incluyen melón amargo, fenogreco, berberina, té verde, genciana, cáscara de naranja y ajenjo.
• Berberina : un ECA de 89 mujeres con resistencia a la insulina y síndrome de ovario poliquístico compararon 500 mg de berberina 3 veces al día con metformina o placebo durante 3 meses. La berberina, comparada con la metformina, disminuyó significativamente la circunferencia de la cintura, la relación cintura-cadera, el colesterol total, los triglicéridos y las LDL y aumentó la HDL y la globulina fijadora de hormonas sexuales. La berberina en comparación con el placebo disminuyó la glucosa plasmática en ayunas, la insulina en ayunas, HOMA-IR y otros parámetros.
• Té verde : el té verde mejora la sensibilidad a la insulina, aumenta la protección de la insulina y mejora el metabolismo de la glucosa. 75 El té verde también aumenta el glutatión y la capacidad antioxidante en personas con síndrome metabólico. 76 En un ensayo controlado, a los pacientes ancianos con síndrome metabólico en el grupo de intervención se les administraron 3 tazas de té verde diariamente durante 2 meses. El té verde fue efectivo para inducir la pérdida de peso y reducir el IMC y la circunferencia de la cintura.
• Setas de Maitake : la seta de Maitake, un adjunto común contra el cáncer, ha demostrado en estudios con animales su capacidad para mejorar la resistencia a la insulina y disminuir la gravedad de la diabetes.
• Canela : la canela aumenta la sensibilidad a la insulina activando los receptores de insulina. Múltiples ECA sugieren que a dosis de 360 mg a 6.000 mg al día, la canela reduce la glucosa en ayunas.
• Holy basil / Tulsi , fenogreco / Trigonella foenum-graecum , y melon amargo / Gymnema son otras hierbas efectivas que sensibilizan la insulina.
La falta de sueño es un obstáculo común para curar la resistencia a la insulina. La tolerancia a la glucosa disminuye de la deuda de sueño. Las estrategias de higiene del sueño incluyen una rutina para irse a la cama, dormir en una habitación completamente oscura, evitar trabajar en el dormitorio, dormir de 3 a 5 pies de distancia de enchufes y dispositivos electrónicos y evitar la cafeína y el alcohol antes de acostarse.
El diagnóstico y tratamiento del cáncer, como factores estresantes crónicos significativos, comúnmente causarán un aumento del cortisol y del ritmo diurno plano. Los niveles altos de cortisol desencadenan hiperinsulinemia en un ciclo negativo en el que la hiperinsulinemia desencadena un cortisol alto. En oncología, existe una evidencia creciente de que el ritmo de cortisol diurno aplanado acelera la progresión tumoral. La curva de cortisol aplanado se asocia con una muerte significativamente más temprana en el cáncer de mama metastásico, prediciendo supervivencia hasta 7 años después. Las curvas planas de cortisol están asociadas con la fatiga en sobrevivientes de cáncer de mama a largo plazo, conteos bajos de glóbulos blancos y actividad suprimida de células asesinas naturales (NK), y depresión, y suprime el crecimiento óseo en los supervivientes que toman medicamentos bloqueadores de hormonas que tienen un mayor riesgo de osteoporosis. Por todas estas razones, la medicina naturopática tiene un papel importante en el tratamiento del cortisol nocturno. Las estrategias incluyen participar en un grupo de cuerpo-mente-espíritu o una clase de manejo del estrés cognitivo-conductual y usar agentes reductores del cortisol como ashwaghanda, teanina, fosfatidilserina, magnolia, Eleuthrococcus , Rhodiola y / o albahaca santa.
Los compuestos obesógenos son sustancias químicas exógenas que afectan la cantidad de células grasas, el tamaño de las células grasas, el apetito, la saciedad, las preferencias alimentarias y el metabolismo energético. La mayoría de los obesógenos conocidos o sospechosos también son sustancias químicas que alteran las hormonas que se han relacionado con el cáncer de mama. Muchos obesógenos están muy extendidos. Como Naturópatas ND, nuestro énfasis está en la prevención de toxinas y la desintoxicación para ayudar al paciente individual. Sin embargo, cuando consideramos el efecto de los obesógenos y las sustancias químicas que alteran las hormonas en las generaciones futuras, resulta evidente que tenemos un papel importante que desempeñar en la medicina preventiva.
Bisphenol-A (BPA) se encuentra en plásticos de policarbonato que se encuentran en el revestimiento de productos enlatados, juguetes, dispositivos médicos, envases de alimentos y bebidas, selladores dentales y recibos de caja registradora. El BPA puede filtrarse en los alimentos de los recipientes de almacenamiento a temperatura ambiente o en el cuerpo al manipular productos fabricados con él. El BPA aumenta las células grasas, puede limitar la adiponectina y parece ser un factor de riesgo independiente para la obesidad. En un estudio transversal de niños y adolescentes informado en JAMA , la concentración urinaria de BPA se asoció significativamente con la obesidad después de controlar por raza / etnia, edad, educación del cuidador, pobreza: relación de ingresos, sexo, consumo de calorías, observación de televisión y creatinina urinaria nivel. Otro estudio que incluyó el Examen Nacional de Salud y Nutrición también mostró que los niños tenían una asociación positiva entre el aumento de los niveles de BPA urinario y la obesidad, independientemente de otros factores de riesgo.
El BPA también se ha visto implicado en el desarrollo del cáncer de mama. Las mujeres posmenopáusicas con altos niveles séricos de BPA y monoetil ftalato tenían una densidad mamaria elevada. Exponer ratas prepúberes al xenoestrógeno El BPA aumentó la susceptibilidad al cáncer de mama en la edad adulta. Los estudios en animales muestran que el BPA disminuye la metilación aguas arriba del gen Agouti, lo que provoca cambios epigenéticos que persisten en las generaciones futuras. El BPA activa la ruta del objetivo mamífero de la rapamicina (mTOR) y reduce importantes puntos de control del cáncer, como p53, p21 y BAX. 103El BPA a dosis ambientalmente relevantes incluso puede reducir la eficacia de los agentes quimioterapéuticos. Las bajas dosis nanomolares de BPA antagonizaron la citotoxicidad de doxorrubicina, cisplatino y vinblastina en células de cáncer de mama.
Los pasos de acción personales incluyen evitar los plásticos de policarbonato (código de reciclaje # 7), productos enlatados y selladores dentales.
De fumar
La nicotina en los productos de tabaco y ciertos insecticidas es un elemento de desarrollo de la obesidad. Los estudios epidemiológicos muestran que los hijos de madres que fumaron durante el embarazo tienen un mayor riesgo de obesidad. Esto ha sido confirmado por estudios en animales que muestran que la nicotina durante el desarrollo prenatal está relacionada con la obesidad en la descendencia. 108 Del mismo modo, la exposición a la nicotina está implicado en la muerte por cáncer de mama. En una revisión sistemática del estudio LACE más 7 estudios adicionales, las mujeres que fumaron después del diagnóstico y tratamiento del cáncer de mama tenían un mayor riesgo de muerte por cáncer de mama (dos veces) y por otras causas (cuatro veces).
Organoclorados: pesticidas, cloruro de polivinilo y dioxinas
Los ejemplos de compuestos organoclorados incluyen pesticidas (p. Ej., DDT [diclorodifeniltricloroetano], aldrina, dieldrina, clordano), PCB [bifenilos policlorados], TCDD (tetraclorodibenzo-p-dioxina) y el cloruro de polivinilo (PVC) plástico y dioxina (que se produce en la fabricación y combustión de compuestos de cloro). Los organoclorados se pueden encontrar en alimentos no orgánicos, envoltorios, persianas, ventanas, pisos, papel tapiz, burletes, cables eléctricos, artículos de cuero artificial, productos médicos y juguetes. Existe evidencia de una asociación positiva entre la diabetes y ciertos compuestos organoclorados, como DDT, DDE, dioxinas y PCB.
Los organoclorados también se han relacionado con el desarrollo del cáncer de mama. Múltiples estudios han demostrado niveles más altos de organoclorados en las biopsias de mama de mujeres con cáncer de mama que en mujeres sin cáncer. Los estudios de población que investigaron los efectos de la exposición a la dioxina con TCDD alta en Seveso, Italia, encontraron que las mujeres en el área tenían un mayor riesgo de cáncer de mama. La exposición ocupacional a dioxinas en una planta de pesticidas en Alemania resultó en un aumento significativo de la mortalidad por cáncer de mama entre las mujeres trabajadoras. Se ha descubierto que al menos 16 organoclorados causan cáncer de mama en animales de laboratorio. Los pasos de acción incluyen comer orgánico cuando sea posible, comer más bajo en la cadena alimentaria, usar un filtro de agua y evitar el plástico de PVC (código de reciclaje n. ° 3) en artículos para el hogar, juguetes, cortinas de baño y ropa de lluvia.
Ftalatos
Los ftalatos no son organoclorados, pero se usan para ablandar el plástico, especialmente el PVC. Se pueden encontrar en fluidos hidráulicos de fracking, cosméticos, fragancias, medicamentos, productos para el cuidado del bebé, materiales de construcción, plastilina, automóviles, materiales de limpieza e insecticidas. Los ftalatos son activadores del receptor activado por el proliferador de peroxisomas (PPAR), lo que significa que afectan la diferenciación de los adipocitos, la producción de adipocinas, la respuesta a la insulina y otros procesos biológicos relacionados con la regulación de la glucosa y los lípidos. Tres estudios transversales en humanos sobre ftalatos muestran asociaciones positivas con diabetes u obesidad.
Los ftalatos también están relacionados con el cáncer de mama. Los niños de los soldados de Nueva Zelanda que sirvieron en Malasia y aplicaron diariamente ftalatos en la ropa para prevenir el tifus arbustivo transmitido por garrapatas tuvieron aumentos en las incidencias de hipospadias, criptorquidia y cáncer de mama ( P <0.05). En un estudio de la misma edad en México de 233 mujeres con cáncer de mama y 221 controles, la exposición al ftalato de dietilo, medida por los niveles de metabolitos en la orina, se asoció con un mayor riesgo de cáncer de mama.
Los ftalatos en los fluidos de fracturación hidráulica pueden contaminar o pueden haber contaminado el agua subterránea. Como destacó un artículo de JAMA de 2012 , hay una escasez de datos que evalúen los impactos del fracking sobre la salud. 118 Entre 2005 y 2009, las empresas en los Estados Unidos utilizaron más de 2.500 productos de fracturación hidráulica que contienen 750 compuestos. Más de 650 de estos productos contienen productos químicos que son conocidos o posibles carcinógenos humanos, regulados por la Ley de Agua Potable Segura, o que figuran como contaminantes peligrosos del aire. Al menos 13 fueron carcinógenos conocidos. La exposición se puede reducir eligiendo cosméticos sin toxinas y evitando el plástico de PVC.
La resistencia a la insulina y el síndrome metabólico son los principales aspectos del terreno de la oncología que pueden y deben ser modificados. Las estrategias de sentido común como el ejercicio, la higiene del sueño y el manejo del estrés han demostrado ser efectivas para normalizar la insulina, el azúcar en la sangre y los lípidos. Estrategias adicionales como la reposición de nutrientes y la medicina a base de hierbas también se pueden incorporar para obtener mejores resultados clínicos. Un área que se pasa por alto en el cáncer de mama y la prevención de la obesidad es la evitación de compuestos obesogénicos. La medicina natural, con su modelo integral de atención, puede desempeñar un papel vital en la identificación y el manejo de la resistencia a la insulina para ayudar a reducir la aparición, recurrencia o progresión del cáncer de mama.
1. Ervin RB. Prevalence of metabolic syndrome among adults 20 years of age and over, by sex, age, race and ethnicity, and body mass index: United States, 2003–2006. National Health Statistics Report. 2009;13.
2. Esposito K, Chiodini P, Capuano A, et al. Metabolic syndrome and postmenopausal breast cancer: systematic review and meta-analysis. Menopause. 2013;20(12):1301-1309.
3. Stebbing J, Sharma A, North B, et al. A metabolic phenotyping approach to understanding relationships between metabolic syndrome and breast tumour responses to chemotherapy. Ann Oncol. 2012;23(4):860-866.
4. Lohsiriwat V, Pongsanguansuk W, Lertakyamanee N, Lohsiriwat D. Impact of metabolic syndrome on the short-term outcomes of colorectal cancer surgery. Dis Colon Rectum. 2010;53(2):186-191.
5. Goodwin PJ, Stambolic V. Obesity and insulin resistance in breast cancer–chemoprevention strategies with a focus on metformin. Breast. 2011;20 Suppl 3:S31-S35.
6. Wallace JM. Individualizing nutrition protocols to complement cancer care. 17th International Symposium on Functional Medicine; Carlsbad, CA; May 20-23, 2010.
7. Goodwin PJ, Stambolic V, Lemieux J, et al. Evaluation of metformin in early breast cancer: a modification of the traditional paradigm for clinical testing of anti-cancer agents. Breast Cancer Res Treat. 2011;126(1):215-220.
8. Aksoy S, Sendur MA, Altundag K. Demographic and clinico-pathological characteristics in patients with invasive breast cancer receiving metformin. Med Oncol. 2013;30(2):590.
9. Jiralerspong S, Palla SL, Giordano SH, et al. Metformin and pathologic complete responses to neoadjuvant chemotherapy in diabetic patients with breast cancer. J Clin Oncol. 2009;27(20):3297-3302.
10. Johansson H, Gandini S, Guerrieri-gonzaga A, et al. Effect of fenretinide and low-dose tamoxifen on insulin sensitivity in premenopausal women at high risk for breast cancer. Cancer Res. 2008;68(22):9512-9518.
11. Lipscombe LL, Fischer HD, Yun L, et al. Association between tamoxifen treatment and diabetes: a population-based study. Cancer. 2012;118(10):2615-2622.
12. Chen X, Margolis KJ, Gershon MD, Schwartz GJ, Sze JY. Reduced serotonin reuptake transporter (SERT) function causes insulin resistance and hepatic steatosis independent of food intake. PLoS ONE. 2012;7(3):e32511.
13. Type 2 diabetes and risk factors. Mayo Clinic website. http://www.mayoclinic.org/diseases-conditions/type-2-diabetes/basics/risk-factors/CON-20031902. Accessed January 12, 2014.
14. Insulin Resistance. Lab Tests Online website. http://labtestsonline.org/understanding/ conditions/insulin-resistance. Accessed January 3, 2014. and Insulin resistance syndrome. WebMD website. http://diabetes.webmd.com/guide/insulin-resistance-syndrome. Accessed January 3, 2014.
15. Poole EM, Shu X, Caan BJ, et al. Postdiagnosis supplement use and breast cancer prognosis in the After Breast Cancer Pooling Project. Breast Cancer Res Treat. 2013;139(2):529-537.
16. Gaudet MM, Patel AV, Teras LR, et al. Obesity-related markers and breast cancer in CPS-II Nutrition Cohort. Int J Mol Epidemiol Genet. 2013;4(3):156-166.
17. Gunter MJ, Hoover DR, Yu H, et al. Insulin, insulin-like growth factor-I, and risk of breast cancer in postmenopausal women. J Natl Cancer Inst. 2009;101(1):48-60.
18. Autier P, Koechlin A, Boniol M, et al. Serum insulin and C-peptide concentration and breast cancer: a meta-analysis. Cancer Causes Control. 2013;24(5):873-883.
19. Alschuler L. Reducing risk of breast cancer by focusing on metabolic parameters. Nat Med J. 2013;5(10). http://www.naturalmedicinejournal.com/article_content.asp?edition=1§ion=3&article=465. Accessed December 20, 2013.
20. Haffner SM. Insulin resistance, inflammation, and the prediabetic state. Am J Cardiol. 2003;92(4A):18J-26J.
21. Chiu KC, Chu A, Go VL, Saad MF. Hypovitaminosis D is associated with insulin resistance and beta cell dysfunction. Am J Clin Nutr. 2004;79(5):820-825.
22. Rose AA, Elser C, Ennis M, Goodwin PJ. Blood levels of vitamin D and early stage breast cancer prognosis: a systematic review and meta-analysis. Breast Cancer Res Treat. 2013;141(3):331-339.
23. Lab Tests Online. http://www.labtestsonline.org. Accessed January 15, 2014.
24. Gaudet MM, Patel AV, Teras LR, et al. Obesity-related markers and breast cancer in CPS-II Nutrition Cohort. Int J Mol Epidemiol Genet. 2013;4(3):156-166.
25. Autier P, Koechlin A, Boniol M, et al. Serum insulin and C-peptide concentration and breast cancer: a meta-analysis. Cancer Causes Control. 2013;24(5):873-883.
26. Alschuler L, Kaczor T. Paper presented at: American Association of Naturopathic Physicians Annual Conference; July 10-13, 2013; Keystone, Colorado.
27. Gaudet MM, Patel AV, Teras LR, et al. Obesity-related markers and breast cancer in CPS-II Nutrition Cohort. Int J Mol Epidemiol Genet. 2013;4(3):156-166.
28. Oh SW, Park CY, Lee ES, et al. Adipokines, insulin resistance, metabolic syndrome, and breast cancer recurrence: a cohort study. Breast Cancer Res. 2011;13(2):R34.
29. Vuorinen-Markkola H, Yki-Järvinen H. Hyperuricemia and insulin resistance. J Clin Endocrinol Metab. 1994;78(1):25-29.
30. Renehan AG, Harvie M, Howell A. Insulin-like growth factor (IGF)-I, IGF binding protein-3, and breast cancer risk: eight years on. Endocr Relat Cancer. 2006;13(2):273-278.
31. Key TJ, Appleby PN, Reeves GK, Roddam AW. Insulin-like growth factor 1 (IGF1), IGF binding protein 3 (IGFBP3), and breast cancer risk: pooled individual data analysis of 17 prospective studies. Lancet Oncol. 2010;11(6):530-542.
32. Minatoya M, Kutomi G, Asakura S, et al. Relationship of serum isoflavone, insulin and adiponectin levels with breast cancer risk. Breast Cancer. 2013;[Epub ahead of print].
33. Oh SW, Park CY, Lee ES, et al. Adipokines, insulin resistance, metabolic syndrome, and breast cancer recurrence: a cohort study. Breast Cancer Res. 2011;13(2):R34.
34. Physical activity and cancer. Cancer.gov website. http://www.cancer.gov/cancertopics/factsheet/prevention/physicalactivity. Accessed January 15, 2014.
35. Holmes MD, Chen WY, Feskanich D, Kroenke CH, Colditz GA. Physical activity and survival after breast cancer diagnosis. JAMA. 2005;293(20):2479-2486.
36. Wu Y, Zhang D, Kang S. Physical activity and risk of breast cancer: a meta-analysis of prospective studies. Breast Cancer Res Treat. 2013;137(3):869-882.
37. Knowler WC, Barrett-connor E, Fowler SE, et al. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med. 2002;346(6):393-403.
38. Knowler WC, Fowler SE, Hamman RF, et al. 10-year follow-up of diabetes incidence and weight loss in the Diabetes Prevention Program Outcomes Study. Lancet. 2009;374(9702):1677-1686.
39. Wing RR, Blair EH, Bononi P, Marcus MD, Watanabe R, Bergman RN. Caloric restriction per se is a significant factor in improvements in glycemic control and insulin sensitivity during weight loss in obese NIDDM patients. Diabetes Care. 1994;17(1):30-36.
40. Henry RR, Gumbiner B. Benefits and limitations of very-low-calorie diet therapy in obese NIDDM. Diabetes Care. 1991;14(9):802-823.
41. Anderson JW, Allgood LD, Turner J, Oeltgen PR, Daggy BP. Effects of psyllium on glucose and serum lipid responses in men with type 2 diabetes and hypercholesterolemia. Am J Clin Nutr. 1999;70(4):466-473.
42. Giacco R, Parillo M, Rivellese AA, et al. Long-term dietary treatment with increased amounts of fiber-rich low-glycemic index natural foods improves blood glucose control and reduces the number of hypoglycemic events in type 1 diabetic patients. Diabetes Care. 2000;23(10):1461-1466.
43. Chandalia M, Garg A, Lutjohann D, Von bergmann K, Grundy SM, Brinkley LJ. Beneficial effects of high dietary fiber intake in patients with type 2 diabetes mellitus. N Engl J Med. 2000;342(19):1392-1398.
44. Chatsudthipong V, Muanprasat C. Stevioside and related compounds: therapeutic benefits beyond sweetness. Pharmacol Ther. 2009;121(1):41-54.
45. Gregersen S, Jeppesen PB, Holst JJ, Hermansen K. Antihyperglycemic effects of stevioside in type 2 diabetic subjects. Metab Clin Exp. 2004;53(1):73-76.
46. Moller K, Krogh-Madsen R. Weight loss with a low-carbohydrate, Mediterranean, or low-fat diet. N Engl J Med. 2008;359(20):2170.
47. Rallidis LS, Lekakis J, Kolomvotsou A, et al. Close adherence to a Mediterranean diet improves endothelial function in subjects with abdominal obesity. Am J Clin Nutr. 2009;90(2):263-268.
48. Liese AD, Nichols M, Sun X, D’agostino RB, Haffner SM. Adherence to the DASH Diet is inversely associated with incidence of type 2 diabetes: the insulin resistance atherosclerosis study. Diabetes Care. 2009;32(8):1434-1436.
49. Fung TT, Hu FB, Wu K, Chiuve SE, Fuchs CS, Giovannucci E. The Mediterranean and Dietary Approaches to Stop Hypertension (DASH) diets and colorectal cancer. Am J Clin Nutr. 2010;92(6):1429-1435.
50. Burke LE, Hudson AG, Warziski MT, et al. Effects of a vegetarian diet and treatment preference on biochemical and dietary variables in overweight and obese adults: a randomized clinical trial. Am J Clin Nutr. 2007;86(3):588-596.
51. Sluijs I, Beulens JW, Van der a DL, Spijkerman AM, Grobbee DE, Van der schouw YT. Dietary intake of total, animal, and vegetable protein and risk of type 2 diabetes in the European Prospective Investigation into Cancer and Nutrition (EPIC)-NL study. Diabetes Care. 2010;33(1):43-48.
52. Harvie MN, Pegington M, Mattson MP, et al. The effects of intermittent or continuous energy restriction on weight loss and metabolic disease risk markers: a randomized trial in young overweight women. Int J Obes (Lond). 2011;35(5):714-727.
53. Partsalaki I, Karvela A, Spiliotis BE. Metabolic impact of a ketogenic diet compared to a hypocaloric diet in obese children and adolescents. J Pediatr Endocrinol Metab. 2012;25(7-8):697-704.
54. Martin J, Wang ZQ, Zhang XH, et al. Chromium picolinate supplementation attenuates body weight gain and increases insulin sensitivity in subjects with type 2 diabetes. Diabetes Care. 2006;29(8):1826-1832.
55. Racek J, Sindberg CD, Moesgaard S, et al. Effect of chromium-enriched yeast on fasting plasma glucose, glycated haemoglobin and serum lipid levels in patients with type 2 diabetes mellitus treated with insulin. Biol Trace Elem Res. 2013;155(1):1-4.
56. Marreiro DN, Geloneze B, Tambascia MA, Lerário AC, Halpern A, Cozzolino SM. Effect of zinc supplementation on serum leptin levels and insulin resistance of obese women. Biol Trace Elem Res. 2006;112(2):109-118.
57. Cohen N, Halberstam M, Shlimovich P, Chang CJ, Shamoon H, Rossetti L. Oral vanadyl sulfate improves hepatic and peripheral insulin sensitivity in patients with non-insulin-dependent diabetes mellitus. J Clin Invest. 1995;95(6):2501-2509.
58. Halberstam M, Cohen N, Shlimovich P, Rossetti L, Shamoon H. Oral vanadyl sulfate improves insulin sensitivity in NIDDM but not in obese nondiabetic subjects. Diabetes. 1996;45(5):659-666.
59. Boden G, Chen X, Ruiz J, van Rossum GD, Turco S. Effects of vanadyl sulfate on carbohydrate and lipid metabolism in patients with non-insulin-dependent diabetes mellitus. Metab Clin Exp. 1996;45(9):1130-1135.
60. Hruby A, Meigs JB, O’donnell CJ, Jacques PF, Mckeown NM. Higher magnesium intake reduces risk of impaired glucose and insulin metabolism and progression from prediabetes to diabetes in middle-aged americans. Diabetes Care. 2014;37(2):419-427.
61. Wang J, Persuitte G, Olendzki BC, et al. Dietary magnesium intake improves insulin resistance among non-diabetic individuals with metabolic syndrome participating in a dietary trial. Nutrients. 2013;5(10):3910-3919.
62. Mooren FC, Krüger K, Völker K, Golf SW, Wadepuhl M, Kraus A. Oral magnesium supplementation reduces insulin resistance in non-diabetic subjects – a double-blind, placebo-controlled, randomized trial. Diabetes Obes Metab. 2011;13(3):281-284.
63. Santamaria A, Giordano D, Corrado F, et al. One-year effects of myo-inositol supplementation in postmenopausal women with metabolic syndrome. Climacteric. 2012;15(5):490-495.
64. Capasso I, Esposito E, Maurea N, et al. Combination of inositol and alpha lipoic acid in metabolic syndrome-affected women: a randomized placebo-controlled trial. Trials. 2013;14:273.
65. Ansar H, Mazloom Z, Kazemi F, Hejazi N. Effect of alpha-lipoic acid on blood glucose, insulin resistance and glutathione peroxidase of type 2 diabetic patients. Saudi Med J. 2011;32(6):584-588.
66. Khan H, Kunutsor S, Franco OH, Chowdhury R. Vitamin D, type 2 diabetes and other metabolic outcomes: a systematic review and meta-analysis of prospective studies. Proc Nutr Soc. 2013;72(1):89-97.
67. Mohr SB, Gorham ED, Alcaraz JE, et al. Serum 25-hydroxyvitamin D and prevention of breast cancer: pooled analysis. Anticancer Res. 2011;31(9):2939-2948.
68. Hodgson JM, Watts GF, Playford DA, Burke V, Croft KD. Coenzyme Q10 improves blood pressure and glycaemic control: a controlled trial in subjects with type 2 diabetes. Eur J Clin Nutr. 2002;56(11):1137-1142.
69. Harris WS. n-3 fatty acids and serum lipoproteins: human studies. Am J Clin Nutr. 1997;65(5 Suppl):1645S-1654S.
70. Banga A, Unal R, Tripathi P, et al. Adiponectin translation is increased by the PPARgamma agonists pioglitazone and omega-3 fatty acids. Am J Physiol Endocrinol Metab. 2009;296(3):E480-E489.
71. Derosa G, Maffioli P, Ferrari I, et al. Comparison between orlistat plus l-carnitine and orlistat alone on inflammation parameters in obese diabetic patients. Fundam Clin Pharmacol. 2011;25(5):642-651.
72. Pham T, Cornea A, Blick KE, Jenkins A, Scofield RH. Oral glucosamine in doses used to treat osteoarthritis worsens insulin resistance. Am J Med Sci. 2007;333(6):333-339.
73. MacDonald J. Blessed bitters. Herb Craft website. www.herbcraft.org/bitters.pdf. Accessed January 15, 2014.
74. Wei W, Zhao H, Wang A, et al. A clinical study on the short-term effect of berberine in comparison to metformin on the metabolic characteristics of women with polycystic ovary syndrome. Eur J Endocrinol. 2012;166(1):99-105.
75. Higdon JV, Frei B. Tea catechins and polyphenols: health effects, metabolism, and antioxidant functions. Crit Rev Food Sci Nutr. 2003;43(1):89-143.
76. Basu A, Betts NM, Mulugeta A, Tong C, Newman E, Lyons TJ. Green tea supplementation increases glutathione and plasma antioxidant capacity in adults with the metabolic syndrome. Nutr Res. 2013;33(3):180-187.
77. Vieira senger AE, Schwanke CH, Gomes I, Valle gottlieb MG. Effect of green tea (Camellia sinensis) consumption on the components of metabolic syndrome in elderly. J Nutr Health Aging. 2012;16(9):738-742.
78. Preuss HG, Echard B, Fu J, et al. Fraction SX of maitake mushroom favorably influences blood glucose levels and blood pressure in streptozotocin-induced diabetic rats. J Med Food. 2012;15(10):901-908.
79. Lu T, Sheng H, Wu J, Cheng Y, Zhu J, Chen Y. Cinnamon extract improves fasting blood glucose and glycosylated hemoglobin level in Chinese patients with type 2 diabetes. Nutr Res. 2012;32(6):408-412.
80. Mang B, Wolters M, Schmitt B, et al. Effects of a cinnamon extract on plasma glucose, HbA, and serum lipids in diabetes mellitus type 2. Eur J Clin Invest. 2006;36(5):340-344.
81. Khan A, Safdar M, Ali khan MM, Khattak KN, Anderson RA. Cinnamon improves glucose and lipids of people with type 2 diabetes. Diabetes Care. 2003;26(12):3215-3218.
82. Sethi J, Sood S, Seth S, Talwar A. Evaluation of hypoglycemic and antioxidant effect ofOcimum sanctum. Indian J Clin Biochem. 2004;19(2):152-155.
83. Gupta A, Gupta R, Lal B. Effect of Trigonella foenum-graecum (fenugreek) seeds on glycaemic control and insulin resistance in type 2 diabetes mellitus: a double blind placebo controlled study. J Assoc Physicians India. 2001;49:1057-6101.
84. Losso JN, Holliday DL, Finley JW, et al. Fenugreek bread: a treatment for diabetes mellitus. J Med Food. 2009;12(5):1046-1049.
85. Kumar SN, Mani UV, Mani I. An open label study on the supplementation of Gymnema sylvestre in type 2 diabetics. J Diet Suppl. 2010;7(3):273-282.
86. Bergner P. Insulin resistance: pathophysiology and natural therapeutics for metabolic syndrome. North American Institute of Medical Herbalism. 2006.
87. Sephton SE, Sapolsky RM, Kraemer HC, Spiegel D. Diurnal cortisol rhythm as a predictor of breast cancer survival. J Natl Cancer Inst. 2000;92(12):994-1000.
88. Bower JE, Ganz PA, Aziz N. Altered cortisol response to psychologic stress in breast cancer survivors with persistent fatigue. Psychosom Med. 2005;67(2):277-280.
89. Sephton SE, Sapolsky RM, Kraemer HC, Spiegel D. Diurnal cortisol rhythm as a predictor of breast cancer survival. J Natl Cancer Inst. 2000;92(12):994-1000.
90. Lutgendorf SK, Weinrib AZ, Penedo F, et al. Interleukin-6, cortisol, and depressive symptoms in ovarian cancer patients. J Clin Oncol. 2008;26(29):4820-4827.
91. Hsiao FH, Jow GM, Kuo WH, et al. The effects of psychotherapy on psychological well-being and diurnal cortisol patterns in breast cancer survivors. Psychother Psychosom. 2012;81(3):173-182.
92. Phillips KM, Antoni MH, Lechner SC, et al. Stress management intervention reduces serum cortisol and increases relaxation during treatment for nonmetastatic breast cancer. Psychosom Med. 2008;70(9):1044-1049.
93. Holtcamp W. Obesogens: an environmental link to obesity. Environ Health Perspect. 2012;120(2):a62-a68.
94. The endocrine disruptor exchange (TEDX) list of potential endocrine disruptors. The Endocrine Disruption Exchange. http://endocrinedisruption.org/endocrine-disruption/tedx-list-of-potential-endocrine-disruptors/overview. Accessed January 15, 2014.
95. A patient handout on reducing risk of exposure to environmental toxins can be found at www.breastcancerfund.org/reduce-your-risk/tips/.
96. Clinicians working with breast cancer can also download the free publication “Body of Evidence: The Connection Between Breast Cancer and the Environment” at www.breastcancerfund.org/media/publications/state-of-the-evidence/.
97. Howdeshell KL, Peterman PH, Judy BM, et al. Bisphenol A is released from used polycarbonate animal cages into water at room temperature. Environ Health Perspect. 2003;111(9):1180-1187.
98. Trasande L, Attina TM, Blustein J. Association between urinary bisphenol A concentration and obesity prevalence in children and adolescents. JAMA. 2012;308(11):1113-1121.
99. Bhandari R, Xiao J, Shankar A. Urinary bisphenol A and obesity in U.S. children. Am J Epidemiol. 2013;177(11):1263-1270.
100. Sprague BL, Trentham-Dietz A, Hedman CJ, et al. Circulating serum xenoestrogens and mammographic breast density. Breast Cancer Res. 2013;15(3):R45.
101. Betancourt AM, Wang J, Jenkins S, Mobley J, Russo J, Lamartiniere CA. Altered carcinogenesis and proteome in mammary glands of rats after prepubertal exposures to the hormonally active chemicals bisphenol a and genistein. J Nutr. 2012;142(7):1382S-1388S.
102. Singh S, Li SS. Epigenetic effects of environmental chemicals bisphenol a and phthalates. Int J Mol Sci. 2012;13(8):10143-10153.
103. Dairkee SH, Luciani-torres MG, Moore DH, Goodson WH. Bisphenol-A-induced inactivation of the p53 axis underlying deregulation of proliferation kinetics, and cell death in non-malignant human breast epithelial cells. Carcinogenesis. 2013;34(3):703-712.
104. Lapensee EW, Lapensee CR, Fox S, Schwemberger S, Afton S, Ben-jonathan N. Bisphenol A and estradiol are equipotent in antagonizing cisplatin-induced cytotoxicity in breast cancer cells. Cancer Lett. 2010;290(2):167-173.
105. Lapensee EW, Tuttle TR, Fox SR, Ben-jonathan N. Bisphenol A at low nanomolar doses confers chemoresistance in estrogen receptor-alpha-positive and -negative breast cancer cells. Environ Health Perspect. 2009;117(2):175-180.
106. Zissu A. Obsogens: avoid chemicals linked to child obesity. Healthy Child website. http://healthychild.org/ what-are-obesogens-and-how-to-avoid-them/. Accessed January 15, 2014.
107. Bisphenol a (BPA). Breast Cancer Fund website. http://www.breastcancerfund.org/clear-science/radiation-chemicals-and-breast-cancer/bisphenol-a.html. Accessed January 3, 2014.
108. Thayer KA, Heindel JJ, Bucher JR, Gallo MA. Role of environmental chemicals in diabetes and obesity: a National Toxicology Program workshop review. Environ Health Perspect. 2012;120(6):779-789.
109. Braithwaite D, Izano M, Moore DH, et al. Smoking and survival after breast cancer diagnosis: a prospective observational study and systematic review. Breast Cancer Res Treat. 2012;136(2):521-533.
110. Thayer KA, Heindel JJ, Bucher JR, Gallo MA. Role of environmental chemicals in diabetes and obesity: a National Toxicology Program workshop review. Environ Health Perspect. 2012;120(6):779-789.
111. Kaur SD. The complete natural medicine guide to breast cancer, a practical manual for understanding, prevention & care. Toronto; R. Rose Inc; 2003.
112. Warner M, Eskenazi B, Mocarelli P, et al. Serum dioxin concentrations and breast cancer risk in the Seveso Women’s Health Study. Environ Health Perspect. 2002;110(7):625-628.
113. Macon MB, Fenton SE. Endocrine disruptors and the breast: early life effects and later life disease. J Mammary Gland Biol Neoplasia. 2013;18(1):43-61.
114. Davis DL, Bradlow HL. Can environmental estrogens cause breast cancer?. Sci Am. 1995;273(4):167-172.
115. Thayer KA, Heindel JJ, Bucher JR, Gallo MA. Role of environmental chemicals in diabetes and obesity: a National Toxicology Program workshop review. Environ Health Perspect. 2012;120(6):779-789.
116. Carran M, Shaw IC. New Zealand Malayan war veterans’ exposure to dibutylphthalate is associated with an increased incidence of cryptorchidism, hypospadias and breast cancer in their children. N Z Med J. 2012;125(1358):52-63.
117. López-carrillo L, Hernández-ramírez RU, Calafat AM, et al. Exposure to phthalates and breast cancer risk in northern Mexico. Environ Health Perspect. 2010;118(4):539-544.
118. Mitka M. Rigorous evidence slim for determining health risks from natural gas fracking. JAMA. 2012;307(20):2135-2136.
119. Waxman HA, Markey EJ, DeGette D. Chemicals used in hydraulic fracturing. United States House of Representatives Committee on Energy and Commerce Minority Staff. April 2011. http://democrats.energycommerce.house.gov/sites/default/files/documents/Hydraulic-Fracturing-Chemicals-2011-4-18.pdf. Accessed January 15, 2014.
120. Anderson LN, Cotterchio M, Vieth R, Knight JA. Vitamin D and calcium intakes and breast cancer risk in pre- and postmenopausal women. Am J Clin Nutr. 2010;91(6):1699-1707.
121. Khan QJ, Reddy PS, Kimler BF, et al. Effect of vitamin D supplementation on serum 25-hydroxy vitamin D levels, joint pain, and fatigue in women starting adjuvant letrozole treatment for breast cancer. Breast Cancer Res Treat. 2010;119(1):111-118.
122. Brasky TM, Lampe JW, Potter JD, Patterson RE, White E. Specialty supplements and breast cancer risk in the VITamins And Lifestyle (VITAL) Cohort. Cancer Epidemiol Biomarkers Prev. 2010;19(7):1696-1708.
123. Bays HE. Safety considerations with omega-3 fatty acid therapy. Am J Cardiol. 2007;99(6A):35C-43C.
124. Elia M, van Bokhorst-de van der Schueren MA, Garvey J, et al. Enteral (oral or tube administration) nutritional support and eicosapentaenoic acid in patients with cancer: a systematic review. Int J Oncol. 2006;28(1):5-23.
125. Bougnoux P, Hajjaji N, Maheo K, Couet C, Chevalier S. Fatty acids and breast cancer: sensitization to treatments and prevention of metastatic re-growth. Prog Lipid Res. 2010;49(1):76-86.
126. Bougnoux P, Hajjaji N, Ferrasson MN, Giraudeau B, Couet C, Le floch O. Improving outcome of chemotherapy of metastatic breast cancer by docosahexaenoic acid: a phase II trial. Br J Cancer. 2009;101(12):1978-1985.
127. Bonatto SJ, Oliveira HH, Nunes EA, et al. Fish oil supplementation improves neutrophil function during cancer chemotherapy. Lipids. 2012;47(4):383-390.
128. Bagga D, Capone S, Wang HJ, et al. Dietary modulation of omega-3/omega-6 polyunsaturated fatty acid ratios in patients with breast cancer. J Natl Cancer Inst. 1997;89(15):1123-1131.
129. Goldberg RJ, Katz J. A meta-analysis of the analgesic effects of omega-3 polyunsaturated fatty acid supplementation for inflammatory joint pain. Pain. 2007;129(1-2):210-223.
130. Patterson RE, Flatt SW, Newman VA, et al. Marine fatty acid intake is associated with breast cancer prognosis. J Nutr. 2011;141(2):201-6.
131. Conklin KA. Coenzyme q10 for prevention of anthracycline-induced cardiotoxicity. Integr Cancer Ther. 2005;4(2):110-130.
132. Sachdanandam P. Antiangiogenic and hypolipidemic activity of coenzyme Q10 supplementation to breast cancer patients undergoing Tamoxifen therapy. Biofactors. 2008;32(1-4):151-159.
133. Hershman DL, Unger JM, Crew KD, et al. Randomized double-blind placebo-controlled trial of acetyl-L-carnitine for the prevention of taxane-induced neuropathy in women undergoing adjuvant breast cancer therapy. J Clin Oncol. 2013;31(20):2627-2633.
134. Kimura Y, Ito H, Hatano T. Effects of mace and nutmeg on human cytochrome P450 3A4 and 2C9 activity. Biol Pharm Bull. 2010;33(12):1977-1982.
135. Kimura Y, Ibid.
136. Wang J, Liu Q, Yang Q. Radiosensitization effects of berberine on human breast cancer cells. Int J Mol Med. 2012;30(5):1166-1172.
137. Li GH, Wang DL, Hu YD, et al. Berberine inhibits acute radiation intestinal syndrome in human with abdomen radiotherapy. Med Oncol. 2010;27(3):919-925.
138. Patil D, Gautam M, Gairola S, Jadhav S, Patwardhan B. Effect of Botanical Immunomodulators on Human CYP3A4 Inhibition: Implications for Concurrent Use as Adjuvants in Cancer Therapy. Integr Cancer Ther. 2013;[Epub ahead of print].
139. Patil D, Gautam M, Gairola S, Jadhav S, Patwardhan B. Effect of Botanical Immunomodulators on Human CYP3A4 Inhibition: Implications for Concurrent Use as Adjuvants in Cancer Therapy. Integr Cancer Ther. 2013;[Epub ahead of print].
140. Liu J, He C, Zhou K, Wang J, Kang JX. Coptis extracts enhance the anticancer effect of estrogen receptor antagonists on human breast cancer cells. Biochem Biophys Res Commun. 2009;378(2):174-178.
141. Sun CL, Yuan JM, Koh WP, Yu MC. Green tea, black tea and breast cancer risk: a meta-analysis of epidemiological studies. Carcinogenesis. 2006;27(7):1310-1315.
142. Chen XQ, Wang XB, Guan RF, et al. Blood anticoagulation and antiplatelet activity of green tea (-)-epigallocatechin (EGC) in mice. Food Funct. 2013;4(10):1521-1525.
143. Zhang G, Wang Y, Zhang Y, et al. Anti-cancer activities of tea epigallocatechin-3-gallate in breast cancer patients under radiotherapy. Curr Mol Med. 2012;12(2):163-176.
144. Mooiman KD, Maas-Bakker RF, Hendrikx JJ, et al. The effect of complementary and alternative medicines on CYP3A4-mediated metabolism of three different substrates: 7-benzyloxy-4-trifluoromethyl-coumarin, midazolam and docetaxel. J Pharm Pharmacol. 2014;[Epub ahead of print].
145. Jodoin J, Demeule M, Beliveau R. Inhibition of the multidrug resistance P-glycoprotein activity by green tea polyphenols. Biochim Biophys Acta. 2002;1542(1-3):149-159.
146. Mei Y, Qian F, Wei D, Liu J. Reversal of cancer multidrug resistance by green tea polyphenols. J Pharm Pharmacol. 2004;56(10):1307-1314.
147. Lecumberri E, Dupertuis YM, Miralbell R, Pichard C. Green tea polyphenol epigallocatechin-3-gallate (EGCG) as adjuvant in cancer therapy. Clin Nutr. 2013;32(6):894-903.
148. Donovan JL, Chavin KD, Devane CL, et al. Green tea (Camellia sinensis) extract does not alter cytochrome p450 3A4 or 2D6 activity in healthy volunteers. Drug Metab Dispos. 2004;32(9):906-908.
149. Engdal S, Nilsen OG. In vitro inhibition of CYP3A4 by herbal remedies frequently used by cancer patients. Phytother Res. 2009;23(7):906-912.
150. Sakata M, Ikeda T, Imoto S, Jinno H, Kitagawa Y. Prevention of mammary carcinogenesis in C3H/OuJ mice by green tea and tamoxifen. Asian Pac J Cancer Prev. 2011;12(2):567-571.
151. Sartippour MR, Pietras R, Marquez-garban DC, et al. The combination of green tea and tamoxifen is effective against breast cancer. Carcinogenesis. 2006;27(12):2424-2433.